Nucleos Estables e Inestables
Un elemento está caracterizado por su numero atómico (cantidad de protones del núcleo del átomo). El comportamiento químico de un átomo está asociado al número atómico. En la tabla periódica se pueden encontrar todos los elementos identificados hasta el presente, que entre naturales y artificiales superan ya los 110.
Los núcleos de los átomos de un mismo elemento químico pueden ser diferentes entre sí, ello se debe a que pueden tener distinta cantidad de neutrones. Para definir completamente de qué núcleo se trata, deberemos entonces decir cuántos protones y cuántos neutrones tiene.
Como la masa del átomo es prácticamente la de su núcleo, y como los protones y los neutrones tienen aproximadamente la misma masa, a la cantidad de protones y neutrones del núcleo se la llama número de masa. Los átomos que tienen un mismo número atómico, pero distintos números de masa se llaman isotopos (este nombre proviene de los términos "iso" y "topos" en griego antiguo, que significan "igual" y "lugar" respectivamente). Pero, ¿de qué "lugar" estamos hablando cuando decimos "isótopos"? Lo que se quiere decir es que todos los isótopos de un mismo elemento se deben colocar en el mismo lugar de la tabla periódica. Hay elementos que tienen hasta 20 ó 30 isótopos diferentes.
A cada uno de esto núcleos diferentes los llamamos "nucleidos". Nuevamente, todos los nucleidos con el mismo número atómico son los isótopos de un único elemento. La cantidad total de nucleidos identificados hasta el presente es muy grande, próxima a los 20

¿Cómo ordenar tanto lío?
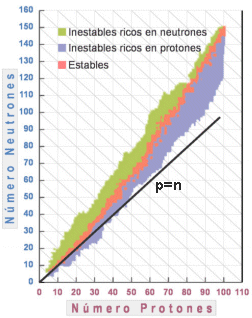
Para sistematizar la información sobre esta cantidad tan apreciable, se ha diseñado una carta o tabla de nucleidos en la cual se los va ubicando en casilleros:
en distintas filas de acuerdo a la cantidad de protones y
en distintas columnas de acuerdo a la cantidad de neutrones.
Así encontraremos que en la fila 8 están los nucleidos que tienen 8 protones, es decir, encontraremos a todos los isótopos del oxígeno. De la misma forma, en la fila 92 estarán todos los isótopos del uranio.

Dentro de cada casillero de la tabla de nucleidos se incluye normalmente información sobre el nucleido en particular, de utilidad para los científicos nucleares. Una información relevante es si el nucleido en cuestión es estable o inestable. Para ello, además de datos numéricos, es común dar a cada casillero un color particular. En nuestra carta de nucleidos hemos pintado de negro los casilleros de los nucleidos estables, mientras que los inestables tienen otro color.
